二氧化碳實驗室制取方法
發布時間:2020-03-28 22:11:00
一、大理石與稀鹽酸反應制取
1、口訣
實驗室制二氧碳,大理石與稀鹽酸。兩種蘇打皆不用,速度太快控制難。
不用硫酸代鹽酸,鎂鹽不如鈣鹽廉。硝酸見光易分解,驗滿瓶口火不燃。
2、反應用品
大理石或石灰石(主要成分是CaCO?)和稀鹽酸。(實驗室制二氧碳,大理石與稀鹽酸)
3、反應原理-反應方程式:
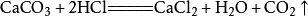
4、實驗室二氧化碳制取裝置,固-液不加熱型(如圖)。
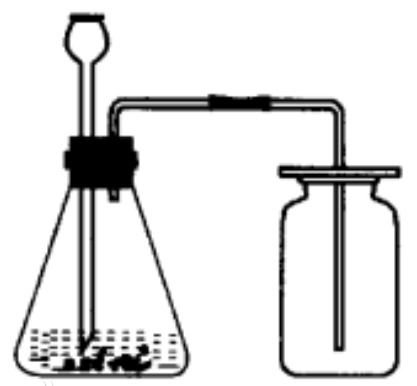
由于二氧化碳密度比空氣大,能溶于水且能與水反應,所以采用向上排空氣法。
6、檢驗方法
將生成的氣體通入澄清的石灰水,石灰水變渾濁,證明該氣體為二氧化碳。
7、驗滿方法
用燃著的木條被在集氣瓶口(不能伸入瓶內),如果火焰熄滅,證明已集滿。
8、注意事項
①反應時可能揮發出的氯化氫(HCl)氣體,可通過飽和碳酸氫鈉(NaHCO3)溶液除去生成氣體中的氯化氫氣體。
②必要時可用裝有濃硫酸的洗氣瓶除去生成氣體中水蒸氣。
③不能用碳酸鈣和濃鹽酸反應,原因:濃鹽酸易揮發出大量氯化氫氣體,使碳酸氫鈉無法完全去除,制得的二氧化碳純度會下降。
④在實驗室中是用大理石(CaCO?)和稀鹽酸反應來制取二氧化碳。
⑤不能用Na?CO?(蘇打)和NaHCO?代替CaCO?(小蘇打)跟鹽酸反應來制取二氧化碳,原因:Na?CO?和NaHCO?跟鹽酸反應的速度太快,產生的二氧化碳很快逸出,不易控制,也不便于操作。(兩種蘇打皆不用,速度太快控制難)
⑥不能用稀硫酸代替鹽酸,原因:稀硫酸跟大理石(CaCO?)反應會生成了微溶入水的硫酸鈣(CaSO?)沉淀覆蓋在大理石的表面上,阻礙了反應的繼續進行,而使反應非常緩慢。(不用硫酸代鹽酸)
⑦不能用MgCO?(鎂鹽)代CaCO?(鈣鹽),原因:雖然MgCO?跟鹽酸與CaCO?跟鹽酸反應相似,但由于MgCO?的來源較少,不如CaCO?廉價易得。(鎂鹽不如鈣鹽廉)
⑧不能用硝酸代替鹽酸,原因:硝酸見光易分解,方程式如下圖
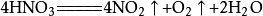
若用硝酸代替鹽酸,則制得的CO?中就會有少量的NO?和O?。此外,硝酸的價格較鹽酸貴,故通常不用硝酸代替鹽酸。(硝酸見光易分解)
⑨因為二氧化碳能滅火,故可以將燃著的火柴置于集氣瓶口檢驗,若火焰熄滅,則證明二氧化碳已經充滿了集氣瓶。(鑒別火柴不能燃)
二、加熱使碳酸氫鈉分解制取
將碳酸氫鈉充分干燥后裝入硬質玻璃管中,在管口處裝填玻璃棉后封閉,用抽氣泵抽真空。然后,加熱使碳酸氫鈉分解。最初發生的二氧化碳可放掉。分解產生的氣體需導入用冰冷卻的導管中,使氣體中的水蒸氣冷凝下來,再將氣體先后導入分別裝有氯化鈣和五氧化二磷的U形管中使其干燥。100℃時,碳酸氫鈉的分解壓為97.458kPa,120℃時為166.652kPa。
三、其他制法
小蘇打(主要成分是碳酸氫鈉)和白醋混合在一起時,發生復分解反應,放出二氧化碳氣體,相應的化學反應方程式為: 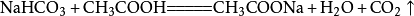
四、工業二氧化碳輸送設備
無錫市長江高壓泵生產廠家二氧化碳泵適用于低溫液態二氧化碳的罐裝與輸送以及二氧化碳萃取加壓泵。可根據壓力流量選型。是用于啤酒、酒精制造廠及有關醫藥、食品工業的專用泵。二氧化碳泵造型美觀、維修方便、使用壽命長。 


 當前位置:
當前位置: